(1.中国人民解放军成都军区总医院消化内科,成都 610083;2.重庆医科大学附属二医院消化内科,重庆 400016)
【摘 要】目的:通过观察P38MAPK信号传导通路特异抑制剂SB203580对乙醛刺激的大鼠肝星状细胞 (Hepatic stellate cells,HSCs)凋亡和bcl-2蛋白表达的影响,探讨P38MAPK信号传导通路与bcl-2蛋白在HSCs中的作用,为肝纤维化的治疗提供理论依据。方法:不同浓度SB203580处理乙醛刺激的HSC-T6,利用MTT法检测SB203580对细胞的抑制作用,ELISA酶联法检测细胞凋亡情况,Western blot法观察bcl-2蛋白表达水平。结果:SB203580抑制乙醛刺激的HSC-T6存活和诱导其凋亡,呈剂量依赖性(F=13.388和F=155.351, P<0.01);随着SB203580浓度增加,bcl-2蛋白表达逐渐降低(F=691.470, P<0.01)。结论:不同浓度SB203580能诱导乙醛刺激的HSC-T6凋亡,其作用机制可能与下调bcl-2蛋白表达有关。
【关键词】SB203580;乙醛;肝星状细胞;bcl-2;凋亡
【中图图书分类法分类号】R575.2
【文献标识码】A 【收稿日期】2011-3-5
Effect of SB203580 on apoptosis and expression of bcl-2 protein in rat hepatic stellate cells
ZHUO Qiang1, ZHENG Ren-yuan1,YE Ping1,TANG Wen1 ,MEI Zhe-chuan2,JIANG Ming-de1
(1.Department of Gastroenterology, General Hospital of Chengdu Military Region ; 2. Department of Gastroenterology, Second Affiliated Hospital of Chongqing Medical University,)
【Abstract】Objective: To investigate the relationship of the apoptosis of rat hepatic stellate cells induced by SB203580 and expression of bcl-2 protein.Methods: HSC-T6 stimulated by acetaldehyde was exposed to SB203580 at different concentrations. The inhibitory effect of SB203580 on cells was detected by MTT. The apoptosis of HSC-T6 was detected by ELISA; the positive expression rate of bcl-2 protein was observed by Western blot.Results: SB203580 induced the apoptosis of HSC-T6 stimulated by acetaldehyde, and all showed the does-dependent trend(F=16.388 andF=155.351, P<0.01).With the concentration of SB203580 increasing, the positive expression rate of bcl-2 protein decreased gradually.(F=382.834, P<0.01)Conclusion: The apoptosis of HSC-T6 stimulated by acetaldehyde is obviously enhanced by SB203580, which maybe result from the down-regulated expression of bcl-2.
【Key words】SB203580; acetaldehyde; hepatic stellate cells; bcl-2; apoptosis
肝星状细胞(Hepatic stellate cells,HSCs)与肝纤维化的发生有着紧密联系[1],活化的HSCs增殖加快,合成胶原等细胞外基质(Extracellular matrix ,ECM)在肝脏过度沉积导致肝纤维化[2]。乙醇的代谢产物乙醛是刺激 HSCs导致肝纤维化发生的关键因子[3,4]。P38MAPK是丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)家族重要成员之一,参与细胞应激、生长、凋亡等过程[5]。经前期实验发现,乙醛刺激的HSCs中P38MAPK磷酸化水平随P38MAPK信号通路特异抑制剂SB203580的增加而降低。本文通过观察SB203580诱导HSC-T6凋亡与bcl-2蛋白表达的关系,进一步探讨肝纤维化的发生机制。
1 材料和方法
1.1 材料
大鼠HSC-T6细胞株(成都医学院实验室),SB203580、BAC蛋白浓度试剂盒(碧云天生物技术研究所),GAPDH、DMEM培养基(美国sigma公司),bcl-2单克隆抗体、免疫组化试剂盒SABC, SDS-PAGE凝胶配制试剂盒(武汉博士德生物工程有限公司),DAB试剂盒(北京中杉金桥生物技术有限公司),小牛血清(成都哈里公司),ELISA试剂盒(德国宝灵曼公司)
1.2 细胞培养
用含10%小牛血清的DMEM培养基,另添加100 U/ml青霉素和链霉素;37℃、5%CO2培养箱中培养HSC-T6,细胞换液时间2~3 d,细胞传代时间3~5 d,传代前用胰酶消化。
1.3 实验分组
对照组(A):含10%小牛血清的DMEM培养液;乙醛组(B):在对照组基础上加入乙醛,使其终浓度为200 μmol/L。试验组(C~E):在乙醛组基础上加入SB203580,使其终浓度分别为4 μmol/l(C),8 μmol/l(D)和16 μmol/l(E)。
1.4 MTT法检测SB203580对细胞的抑制作用
将细胞接种于96孔板中,每组3复孔。待细胞生长至80%融合度后,同步化细胞,加入乙醛和SB203580,培养箱孵育24h(乙醛12h补充一次),再分别加入MTT和DMSO,最后酶标仪测定490 nm波长处酶活性值(OD表示),抑制率=1-实验组OD值/乙醛组OD值。
1.5 ELISA酶联法检测细胞凋亡
取对数生长期细胞接种于25 mL培养瓶,每组3复瓶,调整细胞浓度为1×105 个/ml。待细胞长到80%融合度,细胞同步化,加入乙醛和SB203580,培养箱培养24h(乙醛12h补充一次),4℃,1 500 r/min离心5 min收集细胞,吸弃上清液。按ELISA试剂盒说明书将细胞悬浮于细胞裂解液30 min, 4℃,1 300 r/min离心5 min,吸取上清液,4℃保存待用。于ELISA微孔板上每孔加20 μl待测细胞裂解液和80 μl免疫反应混合液,每组样品重复2次,并设阴性对照。室温下孵育2 h,并在振荡器上轻轻摇晃。孵育缓冲液冲洗3次,彻底移走清洗液。加100 μL底物溶液,室温下振荡, 20 min后用酶标仪,双波长测定其吸光值,测定波长405 nm,参考波长492 nm,样品D值=D405nm-D492nm,即反应细胞凋亡水平。
1.6 Western blot法测定细胞内bcl-2蛋白阳性表达率
细胞处理后,提取细胞用PBS液洗涤,离心,弃上清,裂解,Bradford法测定蛋白浓度。制备12%分离胶,分别取对照组及实验组蛋白,煮沸,离心,取上清液通过SDS-PAGE电泳取凝胶后,转移至PVDF膜上,TBS/T漂洗,4℃封闭过夜。加入一抗和二抗,ECL显色试剂盒显色,照片,曝光,洗片。最后胶片通过Quantity One 4.62分析软件处理,Bcl-2蛋白表达水平以各样本蛋白与GAPDH内参蛋白灰度比值表示。
1.7统计学处理
实验数据均以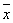 ±s表示,采用SPSS13.0统计软件,多组均数用单因素方差分析,并用t检验对两组间均数进行比较,P<0.05为有统计学意义。
±s表示,采用SPSS13.0统计软件,多组均数用单因素方差分析,并用t检验对两组间均数进行比较,P<0.05为有统计学意义。
2 结果
2.1 SB203580对细胞生长抑制作用的影响
与对照组比较,乙醛可明显促进HSC-T6生长(P<0.01);与乙醛组比较,SB203580对乙醛刺激的HSC-T6有明显的抑制作用,且随着SB203580剂量的增加,抑制作用逐渐增高,差异具有统计学意义(P<0.01),多组均数比较F=16.388,P=0.00。
见表1。
表1 SB203580对细胞存活率影响(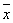 ±s,n=3)
±s,n=3)
组别 |
SB203580+乙醛 (μmol/L) |
OD值 |
抑制率(%) |
A |
0+0 |
0.147±0.010 |
|
B |
0+200 |
0.179±0.016* |
|
C |
4+200 |
0.151±0.011*△ |
18.939 |
D |
8+200 |
0.133±0.007*△ |
25.180 |
E |
16+200 |
0.109±0.007*△ |
38.162 |
*:P<0.01与A组比较;△:P <0.01,与B组比较
2.2 SB203580对细胞凋亡的影响
乙醛组D值明显低于对照组,随着SB203580浓度的不断增高,D值逐渐升高,差异具有统计学意义(F=155.351, P<0.01)。
见表2。
表2 SB203580对乙醛刺激HSC-T6凋亡影响(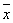 ±s,n=3)
±s,n=3)
组别 |
SB203580+乙醛(μmol/L) |
D值 |
A |
0+0 |
0.101±0.003 |
B |
0+200 |
0.081±0.007* |
C |
4+200 |
0.124±0.009*△ |
D |
8+200 |
0.152±0.003*△ |
E |
16+200 |
0.184±0.004*△ |
*:P<0.01,与A组比较; △:P <0.01,与B组比较
2.3细胞内bcl-2蛋白阳性表达率的变化
Bcl-2蛋白表达在乙醛组最高;实验组随SB浓度增加而逐渐降低,结果具有统计学意义(F=691.470, P<0.01)。见表3和图2。
表3 SB203580对乙醛刺激HSC-T6内Bcl-2蛋白表达影响(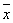 ±s,n=3)
±s,n=3)
组别 |
SB203580+乙醛(μmol/L) |
灰度值(%) |
BCL-2/GAPDH |
A |
0+0 |
21.124±0.976 |
B |
0+200 |
58.962±1.156* |
C |
4+200 |
53.133±0.757*△ |
D |
8+200 |
45.188±1.214*△ |
E |
16+200 |
37.260±0.636*△ |
*:P<0.01,与A组比较; △:P <0.01,与B组比较
3 讨论
HSCs是肝脏的非实质细胞之一,1876年德国CarlvonKupffer在研究肝脏的神经系统时无意中发现肝血窦周围有呈星状形态的细胞,将其命名为星状细胞,1898年,Kupffer对兔肝进行染色时,观察到能吞噬墨水颗粒的肝巨噬细胞,因为同样为星状形态,Kupffer误认为星状细胞就是肝巨噬细胞,1951年,日本学者ToshioIto通过光学显微镜发现人的肝窦周围有一种富含脂质小滴、并且有网状纤维包绕的细胞,并将之命名为伊东细胞(ItoCells)或贮脂细胞(Fat-storingCells),1971年,KenjiroWake发现Ito所描述的伊东细胞和Kupffer所发现的星状细胞原来是同一类型的细胞,并指出上述细胞既不同于肝窦内皮细胞,也不是肝内的巨噬细胞,这种细胞富含VitaminA和脂质小滴,其中脂质小滴发出的自体荧光,以及这种细胞能被氯化金染色的特性都与VitaminA的存在有关,1995年,国际上正式将其命名为HSCs。
肝纤维化发生的中心环节是HSCs的激活[6],目前[7]认为活化的HSCs有两个去向:(1)由激活态转变回静止态;( 2)发生凋亡而死亡。且大多数研究表明,活化的HSC主要通过凋亡途径消除,是肝纤维化消退的主要机制。MAPK信号通路是细胞质和细胞核之间的信号枢纽,是细胞外界信号传递到细胞核内、调节基因表达的重要通路。主要成员包括细胞外信号调节激酶(Extracellular signal-regulated kinases,ERK)、C-jun氨基末端激酶(C-Jun-Nterminal kinase,JNK)和P38MAPK,其中P38MAPK参与细胞增殖、调亡、细胞周期等多种病理生理过程。有报道,P38MPAK对多种细胞具有抗凋亡作用。Keuling[8]研究发现,阻断P38MAPK通路可增强ABT-737诱导的黑色素瘤细胞死亡。Tsukad [9]研究发现,阻断P38MPAK通路可降低培养活化的和TGFp诱导活化的HSCα1(Ⅰ)胶原基因的表达。
细胞凋亡的重要特征之一是Ca2+/ Mg2+依赖性核酸内切酶的激活导致染色质DNA在核小体连接部位断裂,形成180~200bp的单体或寡聚体片段。ELISA采用夹心酶联免疫原理,分别针对DNA片段和组蛋白成分的小鼠单克隆抗体可特性测定细胞凋亡过程中的裂解的单核小体或寡聚合小体[10],从而反映细胞凋亡水平。刘立鹏等[11]用ELISA酶联法研究miR-143对宫颈癌HeLa细胞凋亡的影响;程向东[12]等用上述方法研究证实苦参碱可诱导HepG2细胞凋亡并随剂量增加而增加。
bcl-2蛋白是Bcl-2家族成员之一,可抑制细胞凋亡[13]。bcl-2抑制细胞凋亡机制包括:(1)保护线粒体膜的完整性,防止膜间隙蛋白溢出;(2)阻断细胞内心磷脂的降解和溶酶体酶的破坏等凋亡环节;(3)抵制钙依赖型的细胞损伤;(4)bcl-2还能直接与凋亡蛋白活性因子-1(apaf-1)结合,形成bc1-2/apaf-1/caspase-9复合物,抑制caspase-9对caspase-3的激活作用。bcl-2抑制凋亡可通过位于连接BH3和BH4区的非结构连环中的丝氨酸及苏氨酸残基磷酸化调节,P38为调节其磷酸化过程的激酶之一,P38MAPK激活时可观察到bcl-2磷酸化[14]。生长因子如白介素-3诱导bcl-2磷酸化后,其抑制凋亡的作用增强[15]。我们的数据显示,bcl-2表达随SB203580浓度的增加而降低,说明SB203580调节bcl-2表达,即P38MAPK参与对bcl-2调节,其调节机制需进一步研究。
本实验结果表明SB203580对乙醛刺激HSC-T6细胞抑制增殖及促进凋亡作用,且伴有bcl-2蛋白表达的降低。MTT结果显示,乙醛明显刺HSC-T6细胞增殖,SB203580能抑制乙醛诱导的HSC-T6细胞增殖,且效应随抑制剂浓度的增加而加强;ELISA酶联法通过测定HSC-T6凋亡细胞中断裂单体DNA片段的富集程度而判断HSC-T6凋亡水平。本实验结果提示,乙醛组富集值(D值)明显较对照组低,加入不同浓度的SB203580后,D值随抑制剂浓度增高而升高,说明SB203580促进乙醛刺激的HSC-T6凋亡,且呈剂量依赖关系;Western blot法显示,对照组细胞内bcl-2蛋白低表达,加入乙醛后表达明显增加,实验组bcl-2蛋白表达较对照组高,但比乙醛组低,且随SB203580浓度的增加而逐渐降低,说明SB203580下调乙醛诱导的HSC-T6内bcl-2蛋白表达。结合前期研究,故推测SB203580诱导乙醛刺激的HSC-T6凋亡与SB203580阻断P38MAPK信号通路并下调bcl-2蛋白表达有关。
综上所述,抑制HSCs激活或诱导其凋亡可逆转肝纤维化,本试验用SB203580阻断P38MAPK信号通路研究HSC-T6凋亡,这对进一步阐明肝纤维的机制及探讨肝纤维的可能治疗途径均有重要意义。
参 考 文 献
[1] Marra F,Parola M.Cells in the liver-functions in health and disease[J].Chronic Liver Failure, 2011,1(1):3-32.
[2] Wens R G.Cellular sources of extracellular matrix in hepatic fibrosis[ J ].CIin Liver Dis,2008,12(4):759-768.
[3] Anania F, Womack L, Jiang M,et al.Aldehydes potentiate α2(I) collagen gene activity by JNK in hepatic stellate cells[J].Free Radic BioMed,2001,30(8):846-857.
[4] Huang Y W,Yang S S,Kao J H.Pathogenesis and management of alcoholic liver cirrhosis: a review [J].Hepatic Medicine:Evidence and Research,2011,3(1):1-11.
[5] Brown M D,Sacks D B.Compartmentalised MAPK pathways[J].Handb Exp Pharmacol 2008,186(2):205-235.
[6] Wang Z R ,Wang J H,Hu C L,et al. The effect of down-regulation of Smad3 by RNAi on hepatic stellate cells and a carbon tetrachloride-induced rat model of hepatic fibrosis[J].Braz J Med Biol Res,2011,44(2):91-99.
[7] 李春霞, 戴立里.肝星状细胞与肝纤维化研究进展[J].国际消化病杂志,2007,27(2):108 -111.
[8] Keuling A M, Andrew S E, Tron V A. Inhibition of p38 MAPK enhances ABT-737-induced cell death in melanoma cell lines: novel regulation of PUMA[J].Pigment Cell Melanoma Res,2010,23(3):430-440.
[9] Tsukada S,Westwick J K,Ikejima S N,et al. SMAD and p38 MAPK signaling pathways independently regulate α1(I) collagen gene expression in unstimulated and transforming growth factor-beta—stimulated hepatic stellate cells[J].J Biol Chem,2005,280(11):10055-10064.
[10] 彭黎明,江 虹.细胞凋亡检测方法的研究进展[J].中华病理学杂志,2001,30(2):85-86.
[11] 刘立鹏,于潇华,王晓春,等.miR-143对宫颈癌HeLa细胞增殖和凋亡的影响以及对Bcl-2表达的调节[J].中国药理学通报,2011,27(2):265-269.
[12] 程向东,杜义安,黄 灵,等.苦参碱在调节Bax和Bcl-2蛋白表达诱导HepG2细胞凋亡中的作用[J],中国肿瘤临床,2008,35(12):711-713.
[13] 古晓娜,刘占旗,战景明. MAPKs在Bcl-2家族调控细胞凋亡中的作用[J].国外医学卫生学分册,2008,35(2):65-68.
[14] Chiara G D,Marcocci M E,Torcia M, et al. Bcl-2 Phosphorylation by p38 MAPK identification of target sites and biologic consequences[J].J Biol Chem,2006,281(30):21353-21361.
[15] Ito T,Deng X,Carr B,et al.Bcl-2 phosphorylation required for anti-apoptosis function[J].J Biol Chem,1997,272(18):11671-11673.
图1:正常HSC细胞

图2:各组细胞中BCL-2蛋白表达情况
